Guía completa para el registro de productos farmacéuticos en Perú: Requisitos y Pasos a Seguir
Requisitos para el registro de productos farmacéuticos en Perú
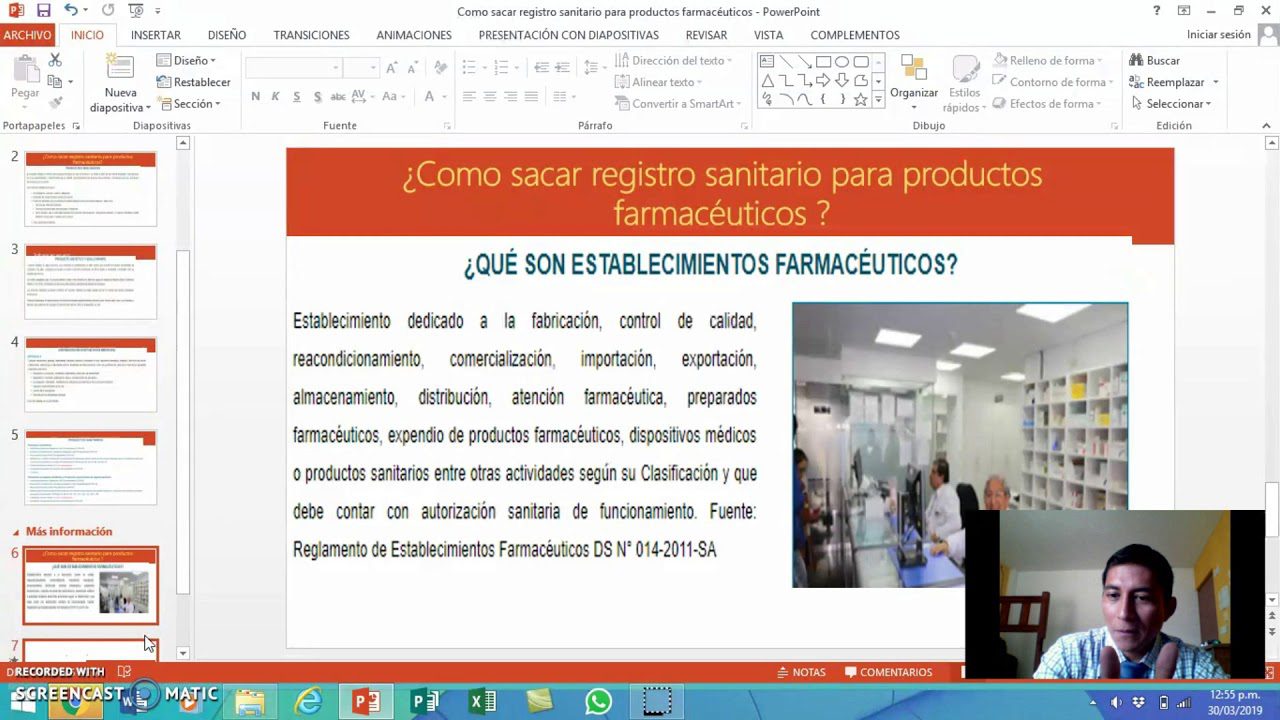
Los requisitos para el registro de productos farmacéuticos en Perú son fundamentales para garantizar la seguridad y eficacia de los medicamentos que se comercializan en el país. En primer lugar, es necesario presentar la documentación técnica correspondiente, incluyendo estudios de calidad, seguridad y eficacia del producto. Además, se deben cumplir con los lineamientos establecidos por la Autoridad Nacional de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios (ANM).
Asimismo, es crucial contar con la asesoría de un representante legal en Perú, quien se encargará de gestionar el proceso de registro ante la autoridad competente. Además, se deben cumplir con los requisitos específicos de etiquetado y empaque, asegurándose de incluir la información obligatoria según la normativa peruana. Es importante destacar que el incumplimiento de alguno de estos requisitos puede retrasar el proceso de registro y la comercialización del producto en el mercado peruano.
En resumen, el registro de productos farmacéuticos en Perú requiere el cumplimiento estricto de una serie de requisitos legales y técnicos, así como la asesoría adecuada para garantizar el éxito del proceso. Estar al tanto de los lineamientos y normativas vigentes es esencial para evitar contratiempos y asegurar la disponibilidad de productos seguros y efectivos en el mercado peruano.
Procedimiento para el registro de productos farmacéuticos en Perú
El procedimiento para el registro de productos farmacéuticos en Perú es un paso crucial para la comercialización de medicamentos en el país. Este proceso está supervisado por la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), la cual establece los requisitos y lineamientos que los fabricantes y distribuidores deben cumplir.
Para iniciar el procedimiento, se debe presentar una solicitud ante la DIGEMID, la cual incluye información detallada sobre el producto farmacéutico, como su composición, formulación, indicaciones terapéuticas, entre otros aspectos relevantes. Además, se requiere presentar evidencia de la calidad, seguridad y eficacia del producto, lo que puede involucrar la presentación de estudios clínicos y de biodisponibilidad.
Una vez presentada la solicitud, la DIGEMID realiza una exhaustiva revisión de la documentación presentada, lo que incluye la evaluación de la información técnica y científica del producto. En caso de cumplir con los requisitos establecidos, se otorga el registro, permitiendo la comercialización del producto en el mercado peruano.
Es importante destacar que el proceso de registro de productos farmacéuticos en Perú está sujeto a regulaciones estrictas, con el fin de garantizar la seguridad y eficacia de los medicamentos disponibles para la población.
Entidades encargadas del registro de productos farmacéuticos en Perú
Las entidades encargadas del registro de productos farmacéuticos en Perú juegan un papel fundamental en el proceso de asegurar la calidad, seguridad y eficacia de los medicamentos disponibles en el mercado. La autoridad competente en esta materia es la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), la cual forma parte del Ministerio de Salud. La DIGEMID es responsable de evaluar y autorizar la comercialización de medicamentos, dispositivos médicos y productos sanitarios en el país, garantizando que cumplan con los requisitos establecidos.
Además, la Comisión Técnica Consultiva de Productos Farmacéuticos y Afines (CTCPFA) es un órgano colegiado adscrito a la DIGEMID, encargado de brindar asesoramiento técnico en la evaluación y registro de medicamentos, dispositivos médicos y productos sanitarios. Esta comisión desempeña un papel crucial en el análisis de la documentación presentada por los solicitantes para el registro de nuevos productos, contribuyendo así a la toma de decisiones informadas por parte de la autoridad sanitaria.
Es importante destacar que el proceso de registro de productos farmacéuticos en Perú está sujeto a normativas específicas que deben ser cumplidas por los fabricantes y titulares de productos para poder ingresar al mercado nacional. Estas normativas buscan proteger la salud pública y garantizar la calidad y eficacia de los productos disponibles en el país, contribuyendo a la seguridad y bienestar de los ciudadanos.
Costos y tiempos del registro de productos farmacéuticos en Perú
El registro de productos farmacéuticos en Perú implica costos y tiempos que deben ser considerados por las empresas interesadas en comercializar sus productos en el país. Los costos varían dependiendo del tipo de producto y el proceso de registro. Es importante tener en cuenta que el registro sanitario de un producto farmacéutico puede implicar gastos asociados a la presentación de documentación, análisis de laboratorio, y otros trámites administrativos.
Además, los tiempos de registro pueden ser considerablemente largos, ya que el proceso requiere la evaluación minuciosa de la documentación presentada. Las autoridades sanitarias en Perú deben asegurarse de que el producto cumple con los estándares de calidad y seguridad antes de autorizar su comercialización.
Es fundamental que las empresas que buscan registrar productos farmacéuticos en Perú consideren estos costos y tiempos en su planificación, para evitar contratiempos y ajustar sus expectativas en relación al lanzamiento comercial de sus productos en el mercado peruano.
Normativas y aspectos legales del registro de productos farmacéuticos en Perú
En Perú, el registro de productos farmacéuticos está regulado por la Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) del Ministerio de Salud. Para llevar a cabo este proceso, es fundamental cumplir con las normativas establecidas por dicha entidad, las cuales buscan garantizar la calidad, seguridad y eficacia de los productos que se comercializan en el país. Es indispensable realizar un exhaustivo análisis de la normativa vigente y los requisitos específicos para cada tipo de producto farmacéutico, asegurándose de cumplir con todos los lineamientos establecidos.
Además, es importante tener en cuenta los aspectos legales relacionados con el registro de productos farmacéuticos en Perú, como la documentación requerida, los procedimientos administrativos, los plazos establecidos y las posibles sanciones por incumplimiento. Es fundamental contar con asesoría legal especializada para garantizar el cumplimiento de todas las disposiciones legales y evitar contratiempos durante el proceso de registro.
En este sentido, conocer a fondo las normativas y aspectos legales del registro de productos farmacéuticos en Perú es esencial para garantizar el éxito en este trámite, así como para asegurar la protección de la salud pública y el cumplimiento de las regulaciones establecidas por las autoridades competentes.
Lo más buscado:
 Cómo Obtener el Código de la Unidad Ejecutora: Guía Completa para Trámites en Perú
Cómo Obtener el Código de la Unidad Ejecutora: Guía Completa para Trámites en Perú  Descarga gratis un modelo de declaración jurada simple en Word para trámites en Perú
Descarga gratis un modelo de declaración jurada simple en Word para trámites en Perú  Sunarp Consulta Vehicular por DNI: Todo lo que necesitas saber para realizar trámites de manera sencilla en Perú
Sunarp Consulta Vehicular por DNI: Todo lo que necesitas saber para realizar trámites de manera sencilla en Perú  Descarga Gratis el Modelo de Carta Poder en Word – Formato Legal para Perú
Descarga Gratis el Modelo de Carta Poder en Word – Formato Legal para Perú  Guía completa para la crianza de pavos bebés en Perú: requisitos, cuidados y trámites necesarios
Guía completa para la crianza de pavos bebés en Perú: requisitos, cuidados y trámites necesarios  ¿Es posible emitir un recibo por honorarios con fecha anterior en Perú? Todo lo que necesitas saber
¿Es posible emitir un recibo por honorarios con fecha anterior en Perú? Todo lo que necesitas saber  Descubre cómo averiguar el nombre de tus padres con tu DNI en Perú: Guía paso a paso
Descubre cómo averiguar el nombre de tus padres con tu DNI en Perú: Guía paso a paso  Guía completa: Cómo solicitar donaciones en Perú de manera eficaz
Guía completa: Cómo solicitar donaciones en Perú de manera eficaz  Descarga Gratis: Formato 5.1 del Libro Diario en Excel para Trámites en Perú
Descarga Gratis: Formato 5.1 del Libro Diario en Excel para Trámites en Perú  Todo lo que necesitas saber sobre la boleta de pago electrónica en el MINSA en Perú: trámites, requisitos y más
Todo lo que necesitas saber sobre la boleta de pago electrónica en el MINSA en Perú: trámites, requisitos y más